Newsletter DPT Nro. 53
ISSN 2618-236X
Octubre / 2020
RESEÑAS DE ARTÍCULOS INTERNACIONALES
Terapias génicas de vectores virales
Con procesos de fabricación escalables y reproducibles
Para obtener la aprobación de productos para terapias génicas es esencial demostrar su seguridad y eficacia mediante rigurosos ensayos clínicos pautados por los entes reguladores. Pero también es importante la forma en que se fabrican estos productos. Los procesos y protocolos de fabricación que garantizan la seguridad, la pureza y la coherencia de las terapias génicas son fundamentales para el proceso de aprobación.
La aprobación, por parte de la Administración de Drogas y Alimentos de los EE.UU. (FDA), de Luxturna (voretigene neparvovec-rzyl) para tratar la distrofia retiniana asociada a la mutación RPE65 y de Zolgensma (onasemnogene abeparvovec-xioi) para tratar la atrofia muscular espinal relacionada con SMN1, han validado terapias génicas con virus adenoasociado (AAV) como enfoques transformadores para tratar enfermedades que exhiben importantes necesidades insatisfechas.
Desafíos de fabricación
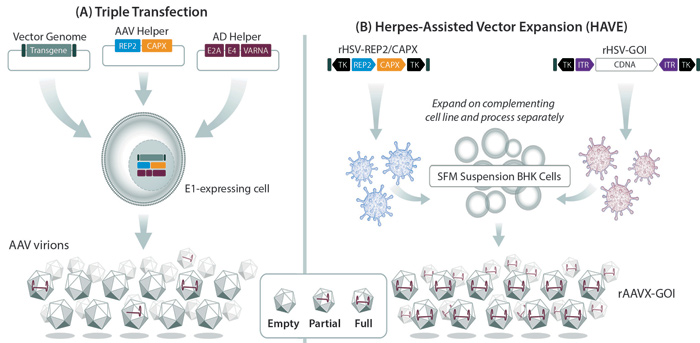
Sin perjuicio de la referida validación de la terapia génica vectorizada por virus adenoasociado (AAV) como una modalidad de tratamiento eficaz en múltiples indicaciones de enfermedades, la fabricación sigue planteando un desafío para ampliar la cartera de productos basados en AAV. Ello se debe a la complejidad de producir vectores de AAV recombinantes, que requiere la introducción simultánea de secuencias de ADN que codifican los genes de replicación (rep) y de cápside (cap) de AAV, un gen terapéutico y genes de función auxiliar que son esenciales para la replicación de AAV en la célula. Las células que reciben los genes rep, cap y de función auxiliar pero carecen del gen terapéutico podrían producir vectores vacíos que carecerían de potencial terapéutico.
Por otra parte, varios procesos de fabricación de AAV utilizan células adherentes que deben cultivarse en contacto con la superficie de recipientes o de placas de cultivo de tejidos. Una limitación inherente a estos procesos es que sólo pueden escalarse aumentando el área de superficie, pero no aumentando el volumen. Elllo significa que la producción solo podría aumentarse incrementando el número de recipientes de cultivo, como bandejas apiladas o recipientes rotativos, lo que aumenta significativamente los requisitos de espacio físico y los costos de fabricación. Además, la gestión y procesamiento de muchos recipientes requiere personal adicional y aumenta los riesgos de contaminación y errores de procesamiento.
Una necesidad urgente
Incluso con las referidas limitaciones, muchos procesos de fabricación de AAV de laboratorio y de la industria continúan dependiendo de la transfección transitoria de células adherentes. Aunque los procesos adherentes pueden respaldar el desarrollo clínico preclínico y temprano, por lo general no son lo suficientemente robustos para las necesidades de fabricación a los fines comerciales o clínicos en etapa tardía. Esto se debe a que tienden a producir una proporción baja de vector activo por volumen de cultivo de tejidos.
La alta productividad volumétrica es esencial para desarrollar un proceso de fabricación de AAV rentable que pueda satisfacer las necesidades comerciales y de etapa tardía. Dichos procesos también podrían permitir volúmenes reducidos de reactivos, lo que a su vez podría reducir los costos de los reactivos y el tamaño de las instalaciones. La escalabilidad es importante para abordar las enfermedades raras y las indicaciones de dosis bajas desde una perspectiva de costos, mientras se atienden las indicaciones más comunes desde una perspectiva de viabilidad.
Las limitaciones de los procesos de fabricación con células adherentes exigen enfoques alternativos. Los métodos basados en baculovirus y adenovirus que se sustentan en células cultivadas en suspensión permiten procesos de fabricación escalables que utilizan biorreactores comúnmente operados para la producción de terapias de anticuerpos y proteínas recombinantes en condiciones de buenas prácticas de fabricación. Sin embargo, esos enfoques tienen sus propias limitaciones.
Soluciones por expansión de vectores
La expansión de vectores asistida por herpes (EVAH) proporciona un método robusto, escalable y altamente productivo para fabricar vectores de AAV. La producción de vectores de AAV de virus del herpes simple (VHS) supera las limitaciones de los sistemas basados en baculovirus mediante el uso de células de mamíferos, y los vectores de VHS eliminan la necesidad de desarrollar múltiples líneas de células productoras que de otro modo se requerirían con sistemas basados en adenovirus.
Los procesos EVAH ofrecen varias ventajas clínicas y reglamentarias sobre otros métodos de producción de AAV. En primer lugar, han demostrado el éxito de la química, la fabricación y los controles en el desarrollo clínico temprano. Las adaptaciones del sistema han proporcionado material para seis aplicaciones exitosas de nuevos fármacos en investigación sin ningún tipo de retención clínica. Los facilitadores EVAH de construcción de vectores muestran una vigorosa estabilidad. Los investigadores han podido desarrollar y transferir ensayos específicos de productos a socios de organizaciones de investigación por contrato. Todos los procesos de EVAH se han transferido con éxito a socios de la industria y organizaciones de fabricación por contrato.
Fuente primaria: “Viral-Vectored Gene Therapies: Harnessing Their Potential Through Scalable, Reproducible Manufacturing Processes”. by Sue Washer and David R. Knop. Bio Process International. June 10, 2020


