Newsletter DPT Nro. 49
ISSN 2618-236X
Junio 2020
Modulación de receptores olfativos
Hallazgos con microscopía tridimensional de alta velocidad
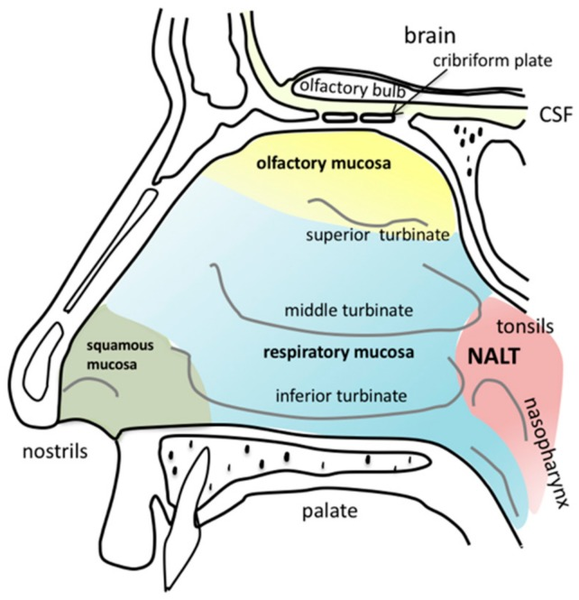
La nariz humana, y el hocico de los demás mamíferos, son fabulosos sensores químicos que pueden detectar y diferenciar un inmenso y diverso repertorio de pequeñas moléculas orgánicas. Lo hacen a través de una gran red de receptores, acoplados a proteínas G, expresados en neuronas sensoriales olfativas sobre un epitelio profundo dentro de la cavidad nasal.
Un determinado olor activa subconjuntos específicos de receptores que lo codifican, y ciertos centros cerebrales superiores interpretan esos códigos para crear una percepción. Pero usualmente no percibimos olores “puros”, sino ricas mezclas de olores. Por ejemplo, un simple pocillo con café emite unos 800 componentes volátiles.
Para estudiar cómo codifica el sistema olfativo esa compleja información, un equipo de investigadores de la Columbia University en New York City exploró cómo responden las neuronas olfativas de ratones a una serie de mezclas de olores. El análisis fue viabilizado por un método de microscopía con imagen tridimensional (3D) de alta velocidad denominado SCAPE (“Swept Confocally Aligned Planar Excitation”), que permite monitorear -en paralelo- las respuestas de miles de neuronas individuales dentro del epitelio olfativo intacto durante la detección de combinaciones de olores.
El método SCAPE permitió observar -por primera vez y en “tiempo real”- cómo reaccionó el epitelio olfativo del ratón a los olores complejos. Así pudieron medirse –simultáneamente- miles de células nerviosas olfativas mientras respondían a diferentes olores calificados como “almendras”, “florales” y “cítricos”. Sin embargo, cuando se mezclaron dos o tres olores, pudieron registrarse múltiples respuestas interactivas de células nerviosas, con una complejidad mucho mayor que la esperada. Dada la enorme cantidad de datos recopilados, el equipo debió desarrollar nuevos métodos de análisis y nuevos dispositivos para manejar los cómputos.
Los artículos aquí reseñados aportan datos inéditos para comprender cómo se codifican las mezclas de olores, así como la notable complejidad de las interacciones olor / receptor. Por otra parte, dado que varios trastornos neurológicos (como las enfermedades de Alzheimer y de Parkinson), así como enfermedades sistémicas (como COVID-19), tienen -a menudo- la pérdida del olfato (anosmia, hiposmia) como un síntoma temprano, una mejor comprensión de las causas de ese síntoma podría contribuir a una detección temprana de dichas patologías.
Se verificó que la intrincada modulación de receptores olfativos periféricos es crucial para discriminar mezclas complejas de olores con patrones de activación superpuestos, ya que dicha modulación evita la saturación de los receptores y permite que cada nuevo componente influya sobre el patrón de activación general. Este resultado sugiere que, para construir una percepción olfativa, las regiones cerebrales superiores desarrollarían un proceso de “inferencia” por reconocimiento de patrones (“pattern recognition”) más que una simple lectura de un código aditivo predeterminado. El estudio muestra también la aptitud del método de microscopía utilizado (SCAPE) para observar y analizar una miríada de respuestas unicelulares dentro del epitelio olfativo intacto.
Fuente primaria 1: “Widespread receptor-driven modulation in peripheral olfactory coding”. Lu Xu, Wenze Li, Venkatakaushik Voleti, Dong-Jing Zou, Elizabeth M. C. Hillman, Stuart Firestein. Science, Vol. 368, Issue 6487, eaaz5390. 10 Apr 2020: DOI: 10.1126/science.aaz5390
Fuente primaria 2: “Alterations in Smell or Taste in Mildly Symptomatic Outpatients With SARS-CoV-2 Infection”. Giacomo Spinato, Cristoforo Fabbris, Jerry Polesel, Diego Cazzador, Daniele Borsetto, Claire Hopkins, Paolo Boscolo-Rizzo. JAMA (Journal of the American Medical Association). . Published online April 22, 2020. DOI: 10.1001/jama.2020.6771


