Newsletter DPT Nro. 57
ISSN 2618-236X
Febrero / 2021
NOTICIAS CIENTIFICAS
NOTICIAS CIENTIFICAS NACIONALES
La ANMAT aprobó el uso del suero equino hiperinmune anti-SARS-CoV-2
Para el tratamiento en pacientes adultos con COVID-19 moderada a severa
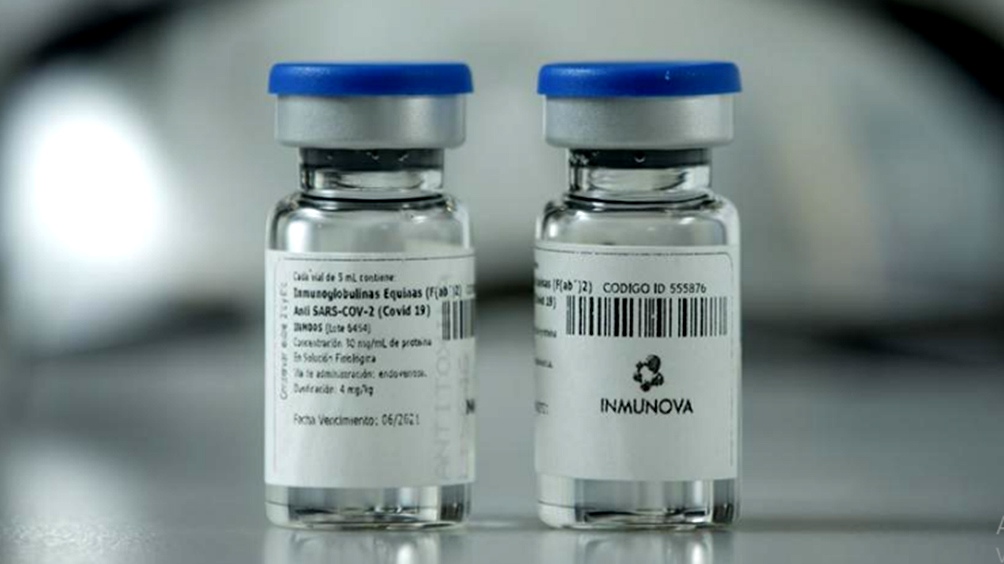
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) aprobó, el 22/12/2020, el uso del suero hiperinmune anti-SARS-CoV-2 (INM005, CoviFab®) para el tratamiento de pacientes adultos con enfermedad COVID-19 moderada a severa. La aprobación de este medicamento innovador, basado en anticuerpos policlonales, se fundamentó en los resultados positivos del estudio clínico de Fase 2/3, los cuales mostraron que la aplicación de esta terapia redujo en un 45% la mortalidad en pacientes con COVID-19 severa.
Este proyecto fue uno de los seleccionados por la Agencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación en la convocatoria “Ideas Proyecto COVID-19”, en el marco de la Unidad Coronavirus creada por el Ministerio de Ciencia, Tecnología e Innovación, el CONICET y la Agencia.
Los pacientes tratados con el suero registraron, con relación al placebo, una reducción del 24% en internación en terapia intensiva y del 36% en requerimiento de asistencia respiratoria mecánica. Además, mostraron un beneficio clínico considerable a lo largo de los 28 días de seguimiento del tratamiento y mejora significativa de 2 puntos en la escala ordinal de evaluación clínica de 8 puntos de la OMS a los 7, 14 y 21 días. Esta escala establece parámetros como la externación con o sin limitación en las actividades, hospitalización con o sin necesidad de oxígeno y soporte de asistencia respiratoria mecánica, entre otros. Los efectos positivos mencionados se observaron en la población bajo estudio, y en particular, en los pacientes con enfermedad de curso severo.
El estudio clínico pudo llevarse a cabo en los tiempos previstos gracias al compromiso y esfuerzo de investigadores y personal de la salud de los centros participantes, así como del comité independiente de médicos especialistas que realizaron los análisis de seguridad. Además, desde el inicio, se interactuó con la autoridad reguladora ANMAT.
Se evaluó la seguridad y eficacia del medicamento en 242 pacientes adultos (de 18 a 79 años) con enfermedad moderada a severa causada por la infección del SARS-CoV-2, confirmada por PCR, dentro de 10 días del inicio de síntomas y que requerían hospitalización. Se realizó en 19 hospitales y clínicas de AMBA, Neuquén y Tucumán. El promedio de edad fue de 54 años, con una participación del 65% de varones y 35% de mujeres).
A partir del Registro Bajo Condiciones Especiales de ANMAT, el producto estará disponible para su aplicación en pacientes con enfermedad COVID-19 moderada a severa, con la firma de consentimiento informado, ampliando el estudio de su efecto clínico mediante un Plan de Monitoreo de Eficacia y Seguridad consensuado con la ANMAT. Se denominará Covifab y será un suero endovenoso por goteo, a aplicar en dos dosis.
Acerca del suero hiperinmune anti-SARS-CoV-2
Se trata de una inmunoterapia basada en anticuerpos policlonales equinos con gran capacidad neutralizante anti SARS-CoV-2. Se obtienen utilizando como antígeno una proteína recombinante del virus, la cual se produce mediante técnicas de biotecnología. El medicamento se logra a partir del procesamiento de los anticuerpos, generando fragmentos con alta pureza y buen perfil de seguridad.
Los anticuerpos policlonales reconocen y se unen en varias regiones a la molécula clave del virus, bloqueando los sitios de interacción con sus receptores. Como ventaja adicional, pueden producirse rápidamente a gran escala.
Este tratamiento es fruto del trabajo encabezado por Inmunova junto a una articulación público-privada con el Instituto Biológico Argentino (BIOL), mAbxience, Grupo Insud, con el apoyo de la Agencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación dependiente del Ministerio de Ciencia, Tecnología e Innovación, del CONICET, la Fundación Instituto Leloir (FIL), la Administración Nacional de Laboratorios e Institutos de Salud “Dr. Carlos G. Malbrán” (ANLIS), la Universidad Nacional de San Martín (UNSAM) y del Fondo Nacional de Desarrollo Productivo (FONDEP) .
El suero equino hiperinmune está disponible, desde el 11/01/2021, para uso hospitalario y bajo prescripción para las clínicas, obras sociales, prepagas o ministerios de salud que así lo soliciten.
Fuente 1: “La ANMAT aprobó el uso del suero equino hiperinmune anti-SARS-CoV-2: Es. Se evidenció beneficio clínico considerable, la disminución de la necesidad de internación en terapia intensiva y de asistencia respiratoria mecánica”. CONICET Noticias. 22/12/2020
Fuente 2: “Comienza la distribución del suero equino hiperinmune desarrollado en Argentina” Por María Alicia Alvado, Telam. 10/01/2021 Coronavirus


