Newsletter DPT Nro. 91
ISSN 2618-236X
Diciembre / 2023
NOTICIAS CIENTIFICAS
NOTICIAS CIENTIFICAS INTERNACIONALES
¿Podrá cubrirse la demanda de órganos para humanos mediante xenotrasplante de órganos provenientes de animales?
Una reseña de avances y desafíos científicos, tecnológicos y éticos
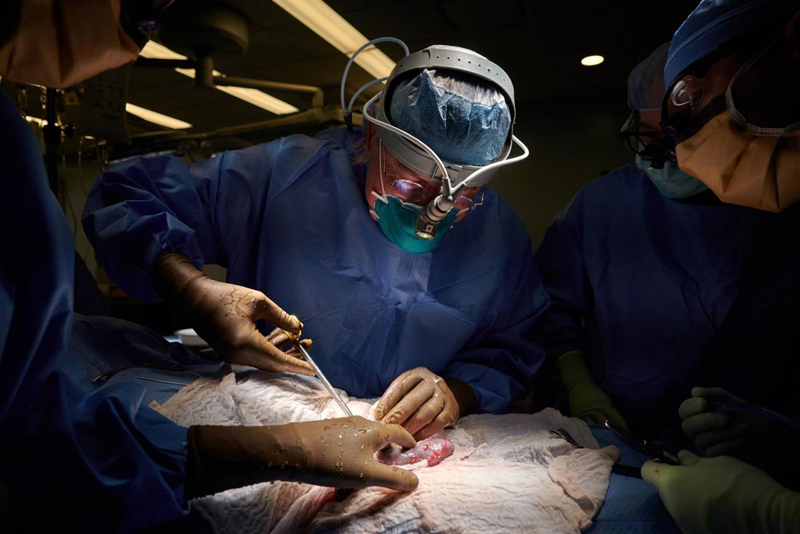
La disponibilidad de órganos y tejidos humanos resulta netamente insuficiente con relación a los millones de pacientes que los necesitan para sobrevivir. Para disponer de órganos suficientes para cubrir la creciente demanda, diversos equipos de investigación apuestan por los xenotrasplantes de órganos provenientes de animales. (*)
La presente reseña comprende seis artículos referidos a trasplantes y xenotraplantes de órganos .En el primero (1) se sintetizan entrevistas a calificados investigadores acerca de.los avances y desafíos científicos, tecnológicos y éticos en materia de xenotrasplantes, así como sobre los equipos impulsores en la Argentina.El segundo (2) se refiere al caso de un xenotrasplante de riñón de cerdo a un humano con muerte cerebral, que exhibió un tiempo récord de funcionalidad sin indicios de rechazo ni de infección. El tercero (3) trata sobre el desarrollo de riñones humanizados en embriones de cerdo. En el cuarto (4) se aborda el caso de un mono trasplantado con riñones de cerdo transgénico que sobrevivió más de 2 años. En el quinto (5) se presenta un dispositivo biolelectrónico para la prevención y detección temprana del riesgo de rechazo de órganos trasplantados. El sexto (6) trata sobre el uso de monos quiméricos para estudiar enfermedades humanas, desarrollar tratamientos y xenotrasplante de órganos.
1.- Primer artículo: Investigación sobre xenotrasplantes en el mundo y en la Argentina (1)
Los primeros intentos de realizar xenotrasplantes se registraron en 1905, cuando se trasplantó un riñón de conejo a un niño con enfermedad renal crónica. Posteriormente, desde la década de 1950 se procuró utilizar órganos de corderos, cerdos y primates.
Tres avances recientes renuevan las expectativas favorables
En EE.UU.se hicieron recientemente -por separado- 2 trasplantes de riñones de cerdos genéticamente alterados en pacientes con muerte encefálica. En el primer caso, el NYU Langone Health (EE.UU.) comunicó que el órgano estuvo funcionando durante 2 meses en el paciente occiso. El otro caso fue comunicado por investigadores de la Facultad de Medicina Heersink de la Universidad de Alabama en Birmingham (EE.UU.), a través de un estudio publicado en la revista JAMA Surgery. Se trató de un paciente que sufría de enfermedad renal crónica y también con muerte cerebral. Le trasplantaron 2 riñones de cerdos que habían sido sometidos a 10 alteraciones genéticas. Los riñones continuaron funcionando durante 7 días.
El tercer avance tuvo lugar en enero de 2022. Médicos-investigadores de la Facultad de Medicina de la Universidad de Maryland (EE.UU.) sorprendieron al mundo con el primer trasplante de un corazón de cerdo (modificado genéticamente) en un paciente humano vivo. Tras recibir el órgano, el paciente -David Bennett- experimentó una función cardíaca sin signos de rechazo, pero 2 meses después de la intervención falleció tras una insuficiencia cardíaca repentina. “Es probable que esa insuficiencia cardiaca haya sido provocada por varios factores superpuestos, entre ellos el mal estado de salud del paciente antes del trasplante, que lo condujo a una inmunodepresión grave”, se afirmó en un artículo publicado en The Lancet en julio pasado. Se infirió que también pudo haber contribuido a la disfunción del trasplante la presencia de un virus latente (citomegalovirus porcino) en el corazón trasplantado.
Los posibles obstáculos para los xenotrasplantes
El profesor Philip Cardiff, de la Escuela de Ingeniería de Materiales y Mecánica y director del Centro Tecnológico Bekaert del Colegio Universitario de Dublin (Irlanda), recibió recientemente U$S 2,1 millones del Consejo de Investigación Europeo para ejecutar -durante 5 años- un proyecto de xenotrasplante. En diálogo con Infobae, Cardiff enunció los principales obstáculos para que los xenotrasplantes puedan ser una solución para muchos pacientes a la espera de un órgano:
“Uno de los obstáculos es el rechazo del órgano por parte del receptor. Cuando se trasplantan órganos de determinadas especies animales a seres humanos, el sistema inmune humano puede reconocer y atacar rápidamente al tejido extraño. Esta respuesta inmunitaria inmediata puede provocar coágulos sanguíneos, inflamación y una falla rápida del órgano”.
Otro obstáculo importante “es la posible transmisión de enfermedades infecciosas del animal donante al receptor humano. Los animales utilizados para xenotrasplantes, como los cerdos, pueden ser portadores de virus inofensivos para ellos, pero nocivos o incluso mortales para el ser humano”.
En tercer lugar, también subsiste la dificultad con la “compatibilidad fisiológica”. “Las diferencias fisiológicas entre los órganos animales y los humanos pueden afectar al funcionamiento del órgano trasplantado en el organismo del receptor y contribuir a la aparición de complicaciones o al fallo del órgano”.
Investigación sobre xenotrasplantes en la Argentina
En la Argentina hay varios grupos de investigación sobre xenotrasplantes. En la Escuela de Bio y Nanotecnologías de la Universidad Nacional de San Martín, el Dr. Adrián Mutto lidera un equipo de investigadores y técnicos que procuran producir cerdos genéticamente modificados para xenotrasplantes.
Otro equipo trabaja en la empresa New Organs Biotech S.A.; startup incubado en la aceleradora GridX con la Facultad de Agronomía de la UBA. Ya lograron producir cerdos editados genéticamente. Contaron con apoyo del Instituto Nacional de Tecnología Agropecuaria (INTA) y de la Facultad de Veterinaria de la UBA y lo anunciaron en febrero pasado: “Obtuvimos los animales con modificaciones a partir del uso de CRISPR para anular al gen que está asociado en el rechazo hiperagudo entre cerdos y primates”, señaló a Infobae el Dr. Daniel Salamone, investigador del CONICET y de la UBA y miembro de la Academia Nacional de Agronomía y Veterinaria.
Objeciones éticas
Adrián Abalovich, director de la comisión de xenotrasplantes de la Sociedad Argentina de Trasplantes y profesor de anatomía y fisiología de la UNSAM, señaló que algunos grupos protectores de animales objetan los xenotrasplantes porque implican la muerte de los cerdos. Al respecto, recordó que “ya la humanidad produce la muerte de millones de cerdos en el mundo para la alimentación. Entonces, ¿por qué no se podrían usar para salvar vidas humanas? Nosotros recibimos el pedido de personas angustiadas por sus seres queridos en situación crítica. Además, cabe tener en cuenta que la mayoría de los medicamentos y las vacunas se han evaluado en investigaciones con animales”.
¿Podrán ser masivos los xenotrasplantes durante la próxima década?
Para Cardiff, “la superación de los obstáculos en los próximos 10 años exigirá una combinación de avances científicos, tecnológicos y normativos. Los avances en ingeniería genética, combinados con fármacos que regulen el sistema inmunitario del receptor, son fundamentales para superar la barrera del rechazo”. ”Para hacer frente al riesgo de infección deben establecerse métodos rigurosos para examinar a los animales donantes en busca de posibles infecciones zoonóticas y garantizar que los órganos trasplantados estén libres de patógenos”. En cuanto a la compatibilidad fisiológica, “es preciso conocer mejor las alteraciones funcionales que provoca la colocación de un órgano animal en un sistema humano. Por otra parte, la confianza sólo puede lograrse demostrando xenotrasplantes exitosos en ensayos clínicos humanos. Mientras tanto, será fundamental sensibilizar a la opinión pública y establecer marcos éticos y normativos sólidos”, sostuvo Cardiff.
Gabriel Gondolesi, director de uno de los laboratorios del Instituto de Medicina Traslacional, Trasplante y Bioingeniería, dependiente de la Universidad Favaloro y del CONICET, y jefe de Cirugía General y de Trasplante Hepático, Pancreático e Intestinal en el Hospital Universitario Fundación Favaloro, dijo a Infobae: “Los últimos avances a partir de los trasplantes de un corazón y de riñones de cerdos modificados en EE.UU. han marcado un cambio significativo. Se usan cerdos porque son animales muy compatibles con los humanos desde el punto de vista anatómico”. “En EE.UU. hay una gran producción de animales modificados para hacer xenotrasplante y cuentan con una mayor inversión tanto pública como privada en investigación”. En países como la Argentina “el desarrollo de los xenotrasplantes es más preliminar. Pero considero que si se logran sortear varios obstáculos es probable que en una década los xenotrasplantes sean una opción segura y eficaz que permitirá superar la escasez de órganos”.
2.- Segundo artículo: Xenotrasplante de riñón de cerdo a un humano con muerte cerebral funcionó durante tiempo récord sin indicios de rechazo ni de infección (2.1.) (2.2.)
Un riñón de cerdo modificado genéticamente, trasplantado a una persona fallecida y mantenida con soporte vital, estuvo funcionando durante 2 meses sin signos de rechazo ni de infección. Se trata del tiempo más prolongado que un riñón de cerdo se mantuvo funcionando dentro de un ser humano. Este fue el quinto trasplante de riñón de cerdo a humano, todos los cuales ocurrieron en personas declaradas con muerte cerebral y mantenidas con soporte vital. Este último procedimiento se realizó el 14/07/2023 y fue dirigido por el Dr. Robert Montgomery, director del Instituto de Trasplantes Langone de la Universidad de Nueva York (NYU Langone Health). El receptor fue Maurice Miller, un varón de 57 años que había sido declarado con muerte cerebral después de complicaciones de una biopsia de un tumor cerebral. Su familia aceptó el procedimiento experimental tras enterarse de que no podía donar sus órganos debido a la naturaleza agresiva de su cáncer cerebral. Se lo mantuvo conectado a un respirador y a otras medidas de soporte vital hasta la conclusión del estudio.
El riñón provino de un cerdo especialmente criado para carecer de un gen que produce un carbohidrato llamado alfa-gal, el cual –por no encontrarse en los humanos- hace que nuestro sistema inmunológico rechace o ataque los órganos provenientes de otros animales. Para reducir aún más el riesgo de rechazo, también se trasplantó a Miller el timo del cerdo (una glándula que ayuda al sistema inmunológico a diferenciar entre células propias y extrañas) y además se le administraron medicamentos inmunosupresores.
Inmediatamente después del trasplante, el riñón comenzó a producir orina, y los niveles de creatinina (un producto de desecho eliminado por los riñones) se mantuvieron en el rango normal, lo que indica una función renal adecuada. Las biopsias del órgano tampoco encontraron signos de rechazo ni de infección.
Finalización del experimento (2.2.)
El experimento finalizó el 13/09/2023, a los 61 días del trasplante. Se extrajo el riñón para someterlo a diversos estudios y el cuerpo se entregó a la familia del paciente. En un comunicado de prensa publicado por NYU Langone Health, el Dr. Montgomery expresó: “Hemos aprendido mucho durante estos 2 meses de estrecha observación y análisis, y hay grandes razones para tener esperanzas en el futuro. El equipo llevará a cabo un estudio en profundidad para analizar los resultados del experimento”.
3.- Tercer artículo: Desarrollo de riñones humanizados en embriones de cerdo (3.1.) (3.2.) (3.3.)
Un equipo de investigadores del Instituto de Biomedicina y Salud de Guangzhou (China) logró desarrollar embriones de cerdo cuyos riñones contienen una combinación de células humanas y porcinas. Esta es la primera vez que se logra cultivar un órgano sólido humanizado dentro de otra especie.
Los investigadores se centraron en los riñones porque son uno de los primeros órganos en desarrollarse y los que más se trasplantan en medicina humana. Miguel A. Esteban, coautor principal del estudio, comenta a SINC que el equipo trabaja en este proyecto desde hace 5 años. A diferencia de los xenotransplantes, en los que se utilizan órganos de animales modificados genéticamente, este método “tiene como finalidad crear -en cerdos- órganos humanos con células de un paciente determinado. Esto evitaría los riesgos de rechazo inmunitario que, por ahora, exhiben los xenotrasplantes”, subraya.
Los investigadores reconocen que la integración de células madre humanas en embriones de cerdo ha sido un gran reto “debido a que las células porcinas superan a las humanas y ambas tienen necesidades fisiológicas distintas”. “Los intentos anteriores de cultivar órganos humanos en cerdos no tuvieron éxito”, señala Liangxue Lai, líder del trabajo. “Nuestra técnica mejora la integración de células humanas en tejidos receptores y nos permite cultivar órganos humanos en cerdos”, destaca.
Un nicho dentro del embrión porcino
El equipo creó primero un nicho dentro del embrión porcino, de manera que las células humanas no tuvieran que competir con las porcinas. “Utilizamos CRISPR Cas9 para manipular genéticamente el embrión unicelular de modo que le faltaran dos genes necesarios para el desarrollo renal”, explica Esteban.
Después modificaron células madre pluripotentes humanas (con potencial para convertirse en cualquier tipo de célula) para hacerlas más susceptibles a la integración y menos propensas a la autodestrucción, desactivando temporalmente su apoptosis (muerte celular programada). A continuación, las convirtieron en células denominadas “naive” (‘ingenuas’), que son parecidas a las primeras células embrionarias humanas, cultivándolas en un medio especial. Posteriormente, antes de implantar en las cerdas los embriones en desarrollo, cultivaron las quimeras en condiciones mejoradas para proporcionar señales y nutrientes diferenciados tanto a las células humanas como a las porcinas, con base en sus respectivos requerimientos. Los investigadores recogieron 5 embriones quiméricos para analizarlos —2 a los 25 días y 3 a los 28 días de la implantación— y comprobaron que tenían riñones estructuralmente normales para su fase de desarrollo (mesonefros; la segunda fase del desarrollo renal), y que éstos estaban compuestos por entre un 50% y un 60% de células humanas.
Implicaciones éticas
Para prevenir problemas éticos, el equipo investigó también si las células humanas contribuían a otros tejidos de los embriones además de los renales. “Las implicaciones éticas serían inquietantes, sobre todo, si las células humanas estuvieran presentes en linajes comprometidos, como tejido neural y germinal, y, especialmente, si esos cerdos llegaran a nacer”, explica Esteban. “De todos modos —añade— estamos siendo muy cautos y avanzando paso a paso para evitar sorpresas. Una de nuestras soluciones es modificar genéticamente las células humanas para que no puedan producir esos linajes comprometidos dentro del embrión de cerdo”, aclara.
Los próximos pasos
Tras mejorar las condiciones para cultivar riñones humanizados en quimeras humano-cerdo, el equipo procura ahora desarrollar los riñones durante más tiempo. También está trabajando para generar otros órganos humanizados en cerdos, como el corazón y el páncreas. A largo plazo, el objetivo es mejorar esta tecnología para el trasplante interespecie de órganos humanos, pero los investigadores reconocen que el trabajo será complejo y podría llevar muchos años. “Como los órganos no están compuestos por un solo linaje celular, para tener un órgano en el que todo proceda del humano, probablemente tendríamos que modificar los cerdos de una forma mucho más compleja y eso también conlleva retos adicionales”, adelanta Esteban.
4.- Cuarto artículo: Un mono trasplantado con riñones de cerdo transgénico sobrevive más de dos años (4.1.) (4.2.) (4.3.)
En el artículo aquí reseñado un equipo de la empresa biotecnológica estadounidense eGenesis anuncia, con base en pruebas con monos, una mejora en la compatibilidad de riñones porcinos para el futuro trasplante en humanos. Dicha empresa, dedicada al desarrollo de órganos compatibles con humanos (Human Compatibility, HuCo™), difundió los datos de supervivencia a largo plazo de un estudio de prueba de concepto que evalúa riñones de donante porcino trasplantados en un modelo de macaco cynomolgus. Informó que uno de los primates trasplantados con riñones porcinos modificados genéticamente sobrevivió 758 días (más de 2 años). “Nuestros resultados representan el conjunto de datos preclínicos más amplio y completo publicado en este campo hasta la fecha. Históricamente, la supervivencia de los receptores del xenotrasplante en este ámbito preclínico se midió en semanas o, como mucho, en meses”.
Michael Curtis, consejero delegado de eGenesis señala que la empresa está enfocada en “la mejora de la supervivencia a largo plazo de los receptores de trasplantes de meses a años”. “Nuestros órganos HuCo™ ofrecen la esperanza de una nueva fuente de donantes para los cientos de miles de personas que necesitan trasplantes de órganos para salvar sus vidas. Los datos publicados ilustran nuestro rápido avance en la ingeniería de órganos de donantes porcinos para mejorar la compatibilidad y la supervivencia a largo plazo, un paso crítico hacia el éxito de la traslación en ensayos clínicos humanos”.
Los riñones de los cerdos donantes evaluados en este estudio llevaban tres (3) tipos de ediciones: (a) El denominado “knock out” [eliminación] de 3 genes implicados en la síntesis de antígenos glicanos involucrados en el rechazo hiperagudo, (b) La inserción de 7 transgenes humanos implicados en la regulación de varias vías que modulan el rechazo: inflamación, inmunidad innata, coagulación y complemento, y (c) La inactivación de los retrovirus endógenos incrustados en el genoma porcino.
Los autores explican que los órganos de los cerdos donantes portadores de transgenes humanos modificados dieron lugar a un mayor tiempo de supervivencia cuando se trasplantaron a los primates. Los riñones que solo contenían “knock out” de los antígenos de los 3 glicanos experimentaron una escasa supervivencia tras el trasplante, mientras que los que además incorporaban los transgenes humanos dieron lugar a una duración más de siete veces superior: una mediana de 24 días frente a 176 días, respectivamente. Los resultados indican el beneficio de la expresión de transgenes humanos en injertos renales porcinos en la supervivencia a largo plazo.
Según Kawai, “Este conjunto de datos demuestra un notable progreso en la edición del genoma porcino para minimizar el rechazo hiperagudo, mejorar la compatibilidad del receptor y abordar el riesgo de transmisión viral del donante al huésped. Prevemos que los resultados de los trasplantes en humanos serán aún más favorables, ya que estos órganos editados genéticamente son más compatibles, en comparación con los primates no humanos”.
5.- Quinto artículo: Un dispositivo bioelectrónico para prevenir rechazo en implante de riñón (5.1.) (5.2.)
Dado que el rechazo por respuesta inmune del receptor representa el 30% de la pérdida de implantes renales, la detección temprana y el tratamiento del rechazo son cruciales para mejorar los resultados y prevenir daños irreversibles.
En el artículo aquí reseñado los autores describen un sistema que proporciona una alerta temprana del rechazo con mayor sensibilidad que los biomarcadores tradicionales. El equipo de investigación desarrolló -en modelos de ratas- una interfaz bioelectrónica implantable para detectar procesos inflamatorios asociados con el rechazo, mediante el monitoreo continuo, en tiempo real, de la temperatura local y la conductividad térmica del riñón. El sistema detecta ritmos ultradianos, alteraciones del ciclo circadiano y/o un aumento de la temperatura renal. Los datos asociados a esas alteraciones proporcionan señales de advertencia de rechazo agudo del trasplante de riñón que preceden a los cambios en la creatinina sérica/nitrógeno ureico en 2 a 3 semanas y aproximadamente 3 días para los casos de administración discontinuada y ausencia de terapia inmunosupresora, respectivamente.
6.- Sexto artículo: Uso de monos quiméricos para estudiar enfermedades humanas, tratamientos y eventual xenotrasplante (6.1.) (6.2.)
Los investigadores llevan largo tiempo intentando crear quimeras animales utilizando células madre embrionarias, que se derivan de la región interna de un embrión y pueden desarrollarse en una amplia variedad de tejidos. Estas células madre se pueden editar genéticamente antes de agregarlas a un embrión receptor. En los primeros monos quiméricos, sólo entre el 0,1% y el 4,5% de las células de órganos como el cerebro, los riñones y los pulmones derivaban de células madre de donantes. Con tan escasa contribución, estas quimeras no eran adecuadas como modelos para enfermedades humanas.
Un equipo de investigadores de la University of Chinese Academy of Sciences in Guangzhou produjo una cría de mono “quimérico” inyectando a un embrión de mono células madre de un embrión donado genéticamente distinto. El animal resultante es el primer primate quimérico nacido vivo que tiene una alta proporción de células procedentes de células madre de donantes.
El hallazgo abre la puerta al uso de monos quiméricos, que son biológicamente más similares a los humanos que las ratas y los ratones quiméricos, para estudiar enfermedades humanas y desarrollar tratamientos. Pero la quimera del mono tuvo que ser sacrificada cuando sólo tenía 10 días debido a hipotermia y dificultades respiratorias, lo que resalta la necesidad de una mayor optimización del enfoque y plantea preocupaciones éticas.
El equipo descubrió que, en promedio, el 67% de las células de los 26 tejidos analizados, incluidos el cerebro, los pulmones y el corazón, eran descendientes de las células madre del donante. El nivel más alto de quimerismo se observó en la glándula suprarrenal: la progenie de las células madre del donante constituía el 92% del total de células.
¿Plataforma para el crecimiento de órganos humanos?
El método podría usarse para cultivar órganos humanos en tejidos de cerdos o de primates no humanos, dice el biólogo celular del desarrollo Shoukhrat Mitalipov, director de la Universidad de Ciencias y Salud de Oregón en Portland. “Si podemos eliminar los genes que codifican, digamos, el riñón, en un animal grande como un cerdo o un primate, podríamos introducir células humanas para producir ese órgano“, afirma. Pero añade que el uso de quimeras entre humanos y animales para la recolección de órganos, especialmente si las células madre embrionarias humanas contribuyen al sistema nervioso, el cerebro o las células reproductivas, conlleva relevantes preocupaciones éticas.
(*) “Quimerismo y xenoimplantes de órganos y tejidos provenientes de cerdos” Newsletter DPT Nº 67, Diciembre 2021
(**) “Xenotrasplantes de órganos de porcinos en humanos: Hitos científico-tecnológicos con alto potencial traslacional” Newsletter DPT Nº 70, marzo 2022
(***) “Xenotrasplante de órganos porcinos para paliar la insuficiencia de donantes humanos de órganos” Newsletter DPT Nº 83, abril 2023.
(****) “El Proyecto “Edición génica porcina para xenotrasplante”, dirigido por el Dr. Rafael Fernández y Martín, resultó finalista del premio MILSTEIN 2023: En enero nacieron 5 lechones editados para el principal gen responsable del rechazo hiperagudo entre cerdos y primates” INPA-UBA / CONICET. Noticias.12 de octubre de 2023
Referencias:
(1) “¿Podrán los cerdos resolver las listas de espera de órganos para los humanos? opinión del Dr.Gabriel Gonolesi, Director del Laboratorio de Investigación Traslacional e Inmunología asociada al Trasplante del IMETTyB (UF-CONICET)” Infobae. Obtenido de Fundación Favaloro. 21 de agosto 2023.
(2.1.) “Pig kidney transplant in brain-dead man still functions after a month: It has been 32 days since Maurice Miller, a dead man who is being kept on life support, received a genetically modified pig kidney, and it is still functioning with no signs of rejection or infection” By Grace Wade.New Scientist Health.16 August 2023
(2.2.) “Doctors remove pig kidney from brain-dead man’s body: The experiment was performed on 58-year-old Maurice Miller, who passed away unexpectedly two months ago”. By Sejal Sharma. Interesting Engineering. Sep. 15, 2023
(3.1.) Fuente primaria: “Generation of a Humanized Mesonephros in Pigs from Induced Pluripotent Stem Cells via Embryo Complementation”.Jiaowei Wang, Wenguang Xie, Nan Li, Wenjuan Li, Zhishuai Zhang, Nana Fan, Zhen Ouyang, Yu Zhao, Chengdan Lai, Hao Li, Mengqi Chen, Longquan Quan, Yunpan Li, Yu Jiang, Wenqi Jia, Lixin Fu, Abdul Mazid, Yanling Zhu, Patrick H. Maxwell, Guangjin Pan, Miguel A. Esteban, Zhen Dai, Liangxue Lai.Cell Stem Cell.Short Article. Volume 30, Issue 9, P1235-1245.E6, September 07, 2023. DOI:10.1016/j.stem.2023.08.003
(3.2.) Fuente secundaria: “Crean riñones humanizados en embriones de cerdo durante 28 días”. Por Ana Hernando.Boletín SINC. No.578.08/09/2023
(3.3.) Fuente complementaria: “Early-stage human kidneys grown in pigs for first time: Approach could eventually yield organs for transplantation” By Mitch Leslie. Science. Newsbiology, 7 Sep 2023
(4.1.) Fuente primaria: “Design and testing of a humanized porcine donor for xenotransplantation” Ranjith P. Anand, Jacob V. Layer, David Heja, Takayuki Hirose, Grace Lassiter, Daniel J. Firl, Violette B. Paragas, Adam Akkad, Sagar Chhangawala, Robert B. Colvin, Russell J. Ernst, Nicholas Esch, Kristen Getchell, Alexandra K. Griffin, Xiaoyun Guo, Katherine C. Hall, Paula Hamilton, Lokesh A. Kalekar, Yinan Kan, Ahmad Karadagi, Feng Li, Susan C. Low, Rudy Matheson, Claudia Nehring, Ryo Otsuka, Matthew Pandelakis, Robert A. Policastro, Rebecca Pols, Luis Queiroz, Ivy A. Rosales, William T. Serkin, Kathryn Stiede, Toshihide Tomosugi, Yongqiang Xue, Gabriel E. Zentner, David Angeles-Albores, J. Chris Chao, Juliet N. Crabtree, Sierra Harken, Nicole Hinkle, Tania Lemos, Mailin Li, Lorena Pantano, Denise Stevens, Omar D. Subedar, Xiaoqing Tan, Shiyi Yin, Imran J. Anwar, David Aufhauser, Saverio Capuano, Dixon B. Kaufman, Stuart J. Knechtle, Jean Kwun, Dhanansayan Shanmuganayagam, James F. Markmann, George M. Church, Mike Curtis, Tatsuo Kawai, Michele E. Youd & Wenning Qin. Nature volume 622, pp.393–401 (2023) Nature. 11 October 2023. Article. Open access. DOI: 10.1038/s41586-023-06594-4
(4.2.) Fuente secundaria 1: “Un mono trasplantado con riñones de cerdo transgénico sobrevive más de dos años” Boletín SINC. Biotecnología. 11/10/2023
(4.3.) Fuente secundaria 2: “Edición genómica para mejorar los trasplantes de órganos de cerdo a humanos” Por Amparo Tolosa, Genotipia. Genética Médica News. Octubre 11, 2023
(5.1.) Fuente primaria: “Implantable bioelectronic systems for early detection of kidney transplant rejection” Surabhi R. Madhvapathy, Jiao-Jing Wang, Heling Wang, Manish Patel, Anthony Chang, Xin Zheng, Yonggang Huang, Zheng J. Zhang, Lorenzo Gallon, And John A. Rogers. Science. Vol 381, Issue 6662. pp. 1105-1112. Research Article. Biomedicine. 7 Sep 2023. DOI: 10.1126/science.adh7726
(5.2.) Fuente secundaria (perspectiva): “Tracking kidney transplant fitness: An implantable bioelectronic device detects the early signs of kidney transplant rejection in rats. Mohamad Zaidan And Fadi G. Lakkis. Science. Vol 381, Issue 6662. pp. 1048-1049. 7 Sep 2023. DOI: 10.1126/science.adj9517
(6.1.) Fuente primaria: “Live birth of chimeric monkey with high contribution from embryonic stem cells”. Jing Cao, Wenjuan Li, Jie Li, Abdul Mazid, Chunyang Li, Yu Jiang, Wenqi Jia, Liang Wu, Zhaodi Liao, Shiyu Sun, Weixiang Song, Jiqiang Fu, Yan Wang, Yong Lu, Yuting Xu, Yanhong Nie, Xinyan Bian, Changshan Gao, Xiaotong Zhang, Liansheng Zhang, Shenshen Shang, Yunpan Li, Lixin Fu, Hao Liu, Junjian Lai, Yang Wang, Yue Yuan, Xin Jin, Yan Li, Chuanyu Liu, Yiwei Lai, Xuyang Shi, Patrick H. Maxwell, Xun Xu, Longqi Liu, Muming Poo, Xiaolong Wang, Qiang Sun, Miguel A. Esteban, Zhen Liu. Cell. Article. Volume 186, Issue 23, pp, 4996-5014. Published: Npvember 09, 2023. DOI:10.1016/j.cell.2023.10.005
(6.2.) Fuente secundaria: “This hybrid baby monkey is made of cells from two embryos: The work paves the way for scientists to use chimeric primates to study human diseases” by Carissa Wong. Nature. News 623, pp. 468-469. Published: 09 November 2023. DOI: https://doi.org/10.1038/d41586-023-03473-w


