Newsletter DPT Nro. 77
ISSN 2618-236X
Octubre / 2022
NOTICIAS CIENTIFICAS
NOTICIAS CIENTIFICAS INTERNACIONALES
Contribuciones para preservar la biodiversidad y la vida
Propuestas biotecnológicas experimentales
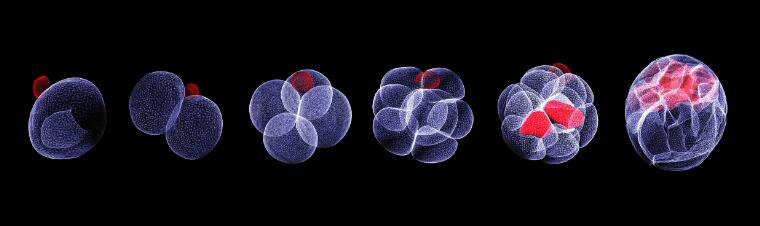
La preservación de recursos genéticos es fundamental para promover la supervivencia de las especies animales y vegetales frente a amenazas como de propagación de enfermedades, desastres naturales o cambios ambientales como el calentamiento global. La presente reseña comprende seis artículos referidos a propuestas biotecnológicas para preservar la biodiversidad y la vida. El primero (1) trata sobre la liofilización como herramienta para preservar recursos genéticos. El segundo (2) aborda la transformación de células madre de ratón en embriones mediante un biorreactor, El tercero (3) se refiere a ratones estériles que generan esperma de rata. El cuarto (4) trata sobre la restauración de la actividad de células y órganos de un cerdo después de su muerte. En el quinto (5) se muestra la viabilidad de la ingeniería cromosómica en mamíferos. En el sexto (6) se describe cómo la comparación genómica entre una medusa inmortal y una mortal revela procesos claves del rejuvenecimiento permanente
1.- Primer artículo: La liofilización como herramienta para preservar recursos genéticos: Podría ser fundamental para promover la supervivencia de especies amenazadas (1.1) (1.2.) (1.3.) (1.4.)
Un biobanco es un centro que recoge, almacena y distribuye colecciones de muestras de origen biológico con destino a actividades de investigación o de preservación de especies en peligro de extinción. Muchas de estas colecciones son crioconservadas en nitrógeno líquido (LN2), que permite preservar muestras biológicas sin alterar su integridad, pero esta técnica exhibe un alto costo de mantenimiento y el riesgo de corte de suministro en caso de accidentes o desastres.
Para superar dichas limitaciones, un equipo de investigadores liderado por Teruhiko Wakayama, de la Universidad de Yamanashi, propone un método más eficiente para preservar muestras de material biológico. En el estudio, el equipo clonó ratones sanos a partir de células liofilizadas que habían sido almacenadas durante nueve meses. La liofilización es una técnica de preservación en la que se deshidrata una muestra sometiéndola a congelación y eliminando posteriormente el hielo por sublimación. Esta técnica se utiliza actualmente para conservar proteínas y otras moléculas de interés terapéutico, así como cultivos bacterianos.
En un primer paso de la investigación, el equipo de Wakayama extrajo células de la granulosa ovárica de ratones hembra. Los autores sometieron a estas células, que producen los esteroides necesarios para la foliculogénesis y la ovulación, a un proceso de liofilización. Tras la liofilización, las células de la granulosa ya no conservaban sus funciones biológicas (no estaban vivas), pero su ADN se mantuvo intacto y funcional, tal y como se demostró en experimentos posteriores. Nueve meses después de la liofilización, el equipo rehidrató las células liofilizadas e introdujo su material genético en oocitos de ratón, generando unos primeros embriones con la información genética de las células liofilizadas. A partir de unos 2.000 embriones obtenidos, sólo se logró obtener 19 ratones clonados sanos que no presentaron alteraciones en su longevidad o su fertilidad. En una segunda prueba con el mismo procedimiento, esta vez a partir de células de ratones machos y hembras, el equipo logró clonar de forma efectiva un total de 56 ratones sanos a partir de poco más de 1.300 embriones. Posteriores análisis demostraron que las hembras obtenidas a partir de la clonación de células liofilizadas no presentaron alteraciones en su capacidad reproductiva y su descendencia no exhibió complicaciones asociadas al proceso de clonación. Los ratones clonados presentaron, además, una longevidad similar a la esperada para ratones normales.
Este estudio supone una mejora en el desarrollo de técnicas más eficientes para la preservación de muestras biológicas, a la vez que evidencia las actuales limitaciones en cuanto al rendimiento de la clonación de células liofilizadas. Futuras investigaciones ayudarán a perfeccionar esta técnica de conservación de material genético para que pueda ser utilizada de forma efectiva en biobancos de una manera segura y de bajo costo.
2.- Segundo artículo: Células madre de ratón se transforman en embriones (2.1.) (2.2.) (2.3.) (2.4.) (2.5.) (2.6.)
La receta para la vida de los mamíferos es simple: “toma un óvulo, agrega esperma y espera”. Pero dos equipos de investigación independientes muestran, a través de sus respectivos artículos ((2.1.) y (2.2.)) que, en las condiciones adecuadas, las células madre pueden dividirse y autoorganizarse en un embrión. Ambos equipos cultivaron modelos de embriones sintéticos de ratones a partir de células madre durante más tiempo que nunca antes. Los embriones crecieron durante 8,5 días (casi la mitad de los 20 días de gestación del ratón). En ese tiempo cada embrión formó un corazón con latidos, circulación sanguínea, un cerebro con pliegues neurales, un tubo neural y un tracto intestinal. En comparación con los embriones naturales de ratón, los modelos sintéticos mostraron una notable similitud en la forma de las estructuras internas y los patrones de expresión génica de diferentes tipos de células. Ambos estudios se empoderan mutuamente por haber sido ejecutados por dos experimentados equipos que obtuvieron resultados bastante similares de manera independiente.
El primer equipo fue liderado por Jacob Hanna en el Departamento de Genética Molecular del Instituto de Ciencias Weizmann de Israel, mientras que el segundo lo fue por Magdalena Zernicka-Goetz, con laboratorios en la Universidad de Cambridge, Reino Unido, y el Instituto de Tecnología de California en Pasadena.
El equipo de Hanna utilizó dos avances previos: (a) un método eficiente para reprogramar las células madre en su etapa más temprana, y (b) un innovador biorreactor controlado electrónicamente para cultivar (con nutrientes y factores de crecimiento) embriones de ratón. El equipo de Zernicka-Goetz contó con el apoyo del equipo de Hanna, quien señaló: “Compartimos el cerebro de nuestro biorreactor con quienes lo pidieron para sus experimentos, incluidos Zernicka-Goetz y sus colegas”. Este equipo realizó también un experimento en el que eliminaron un gen llamado Pax6, que tiene un papel clave en el desarrollo del cerebro, hallando que los cerebros de los ratones no se desarrollaron correctamente, replicando lo que ocurre en los embriones naturales que carecen de ese gen. El resultado muestra “que el sistema es realmente funcional”, dice Zernicka-Goetz.
Para los investigadores, estos modelos sintéticos aportan muchas ventajas sobre los embriones naturales creados a partir de óvulos y espermatozoides. Debido a que crecen fuera del útero, son mucho más fáciles de observar y de manipular con herramientas de edición del genoma. Eso podría hacerlos útiles para descubrir el papel de diferentes genes en defectos de nacimiento o trastornos del desarrollo. Zernicka-Goetz planea usar este modelo para comprender por qué fallan los embarazos. Hanna prevé usar la técnica para desarrollar embriones humanos sintéticos que puedan ser una fuente de nuevos órganos y tejidos para las personas que los necesiten. También podría ayudar a estudiar cómo las células madre forman diversos órganos en el embrión en desarrollo, y algún día viabilizar el cultivo de tejidos y órganos para trasplante utilizando modelos sintéticos de embriones. “El embrión es la mejor máquina para fabricar órganos y la mejor bioimpresora 3D. Intentamos emular lo que hace”, dijo Hanna. También podría ayudar a los investigadores, en gran medida, a evitar los problemas éticos y técnicos relacionados con el uso de embriones humanos en investigación y biotecnología. Dado que los embriones sintéticos (provenientes de células madre) podrían crecer por millones, además de ayudar a reducir el uso de animales en la investigación, podrían convertirse -en el futuro- en una fuente confiable de células, tejidos y órganos sintéticos para trasplante. “En lugar de desarrollar un protocolo diferente para cultivar cada tipo de célula (por ejemplo, las del riñón o del hígado), algún día podría crearse un modelo sintético similar al embrión y luego aislar las células necesarias. No sería necesario dictar a los órganos emergentes cómo deben desarrollarse, ya que el embrión lo hace mucho mejor”, dijo Hanna. “Nuestro próximo desafío es comprender cómo las células madre saben qué hacer, cómo se autoensamblan en órganos y encuentran el camino hacia los lugares asignados dentro de un embrión”, dijo Hanna. “Y dado que nuestro sistema es transparente (a diferencia de un útero) puede resultar útil para modelar diversas anomalías, así como para producir tipos de células que se pueden trasplantar para tratar enfermedades humanas”.
Cuanto más se avanza con estos embriones, mayores son las inquietudes éticas. La Sociedad Internacional para la Investigación de Células Madre emitió pautas señalando que este tipo de investigación debe tener un fundamento científico convincente y usar la cantidad mínima de embriones necesaria para lograr el objetivo científico. A medida que los investigadores vayan trabajando con modelos de embriones humanos que comiencen a desarrollar órganos, será necesario algún tipo de consenso ético y avanzar con cautela y transparencia.
3.-Tercer artículo: Logran que ratones estériles produzcan esperma de rata (3.1.) (3.2.)
En la mitología griega “Quimera” es un monstruo generalmente representado con cabeza de león, cuerpo de cabra y cola de dragón. En el ámbito científico, la palabra “quimera” denota un organismo generado artificialmente a partir de células procedentes de dos o más especies diferentes. En el Newsletter DPT se publicaron diversos artículos vinculados con quimerismo biotecnológico (*).
Las células madre pluripotentes embrionarias (embryonic stem cells, ESC) y las células madre pluripotentes inducidas (induced pluripotent stem cells, iPSC) tienen una propensión única a diferenciarse en cualquier tipo de célula del organismo adulto, incluidas las células germinales. La inyección de PSC de ratón o rata en blastocistos puede producir quimeras que albergan la contribución de PSC en todos los tipos de células y órganos, incluida la línea germinal, lo que convierte a las PSC modificadas genéticamente en un método comúnmente utilizado para la producción de animales transgénicos. Si bien las PSC proporcionan una poderosa herramienta para la investigación biomédica, continúa siendo un desafío la generación de óvulos o espermatozoides a partir de ellas.
En el artículo aquí reseñado investigadores de la Escuela Politécnica Federal (ETHZ) y la Universidad de Zúrich (UZH), ambas en Suiza, describen cómo generaron –mediante complementación de blastocistos interespecie- espermatozoides de rata en ratones estériles. Esta investigación preliminar representa un avance significativo: “Nuestro trabajo proporciona una prueba de principio de que es posible generar espermatozoides de una especie en animales estériles de otra”, comentó a SINC Ori Bar-Nur, biólogo de células madre en ETHZ y autor principal del estudio. Para lograrlo, los investigadores inyectaron PSCs de rata en embriones de ratón en los que se había mutado un gen esencial para la producción de esperma. Como consecuencia de la mutación genética inductora de esterilidad, se desarrolló un nicho vacío dentro de los testículos, lo que permitió que las células de rata los colonizaran y generaran esperma. La sorpresa fue que todos los espermatozoides de las quimeras eran de rata. Ello significa que, a pesar de su esterilidad, el huésped pudo sustentar la producción eficiente de espermatozoides de una especie animal diferente. Cabe señalar que los espermatozoides –si bien parecían morfológicamente indistinguibles de los producidos por ratas normales- eran inmóviles y con bajas tasas de fertilización de óvulos. En el futuro, los autores intentarán producir animales vivos a partir de esperma de rata que se haya producido en quimeras.
Los autores señalan que el estudio abre el camino para dos importantes aplicaciones: (a) mejorar la producción de ratas transgénicas para modelar enfermedades humanas en la investigación biomédica, y (b) producir gametos (óvulos y espermatozoides) de animales en peligro de extinción, para apoyar la conservación de la biodiversidad: “Gracias a este procedimiento, podríamos producir las células germinales de un roedor en peligro de extinción a través de la generación de quimeras”, afirma Bar-Nur.
(*) Ver, por ejemplo, “Quimerismo y xenoimplantes de órganos y tejidos provenientes de cerdos” Newsletter DPT N° 67. Diciembre 2021.
4.- Cuarto artículo: Restauran la actividad de células y órganos de un cerdo después de su muerte (4.1) (4.2.) (4.3.)
El trasplante de tejidos y órganos permite viabilizar, prolongar y mejorar la calidad de vida de pacientes en todo el mundo. Los avances en las técnicas de ablación, conservación, trasplante e inmunosupresión han mejorado la efectividad y aceptabilidad cultural de los trasplantes, con el consecuente aumento de la demanda. Pero existe una continua escasez mundial de órganos trasplantables. Solo en EE.UU. hay 120.000 personas en espera de trasplantes, y cada año mueren miles de pacientes en esa espera. Además de la notoria desproporción entre demandantes y donantes, un problema importante reside en que las células y los órganos comienzan a deteriorarse minutos después de la muerte, lo que restringe sustancialmente los plazos para trasplante. Dado que un solo donante fallecido puede contribuir con varias personas que necesitan una donación (de riñones, hígado, corazón, páncreas, estómago, intestino, pulmones; tejidos óseos, córneas, válvulas cardíacas, etc.) la posibilidad de ampliar el margen de tiempo para el trasplante podría extender sustancialmente la cobertura de necesidades.
Un equipo de investigadores de la Universidad de Yale ha desarrollado una tecnología que permitiría ampliar sustancialmente el tiempo de aptitud de las células y órganos para trasplante. Dicha tecnología -conocida como OrganEx– se compone de: (a) un fluido que contiene hemoglobina sintética (llamada Hemopure, que suministra oxígeno a los glóbulos rojos para que permanezcan funcionales), anticoagulantes, antiinflamatorios y otros medicamentos que contribuyen a preservan la vida celular, y (b) un dispositivo de perfusión que simula la función cardíaca y pulmonar y bombea al fluido a través del sistema circulatorio (o linfático) para mantener los tejidos y órganos viables para el trasplante.
En el artículo aquí reseñado, el referido equipo de Yale describe cómo usando OrganEx restauraron la actividad celular en un cerdo muerto por paro cardíaco (sin sufrimiento). Después de una hora de su muerte, los investigadores aplicaron la técnica OrganEx y, trascurrido un lapso de 6 horas, hallaron funciones celulares y orgánicas restauradas. En el informe de investigación señalaron: “Era difícil notar, con microscopio, la diferencia entre un órgano sano y uno que había sido tratado con tecnología OrganEx después de la muerte”. También se detectaron señales eléctricas que indicaban que el corazón podía contraerse incluso después del paro cardíaco y la muerte. Con tales evidencias de vitalidad de las células y los órganos del cerdo muerto, se demostró que OrganEx es eficaz para: (a) restaurar células y tejidos en órganos dañados por falta de de sangre y oxígeno (isquemia), (b) mantener la vitalidad de células y tejidos incluso después de la muerte, (c) preservar diversos órganos simultáneamente.
OrganEx es una versión avanzada de BrainEx, una técnica que previamente permitió a los investigadores restaurar funciones celulares y actividades moleculares en el cerebro de un cerdo después de la muerte (*). Los investigadores prevén ahora avanzar con OrganEx para restaurar las funciones de todo el cuerpo en grandes mamíferos, señalando que se requerirá mayor investigación antes de que pueda probarse en humanos. Sugieren que una vez que la tecnología tenga éxito con órganos humanos, podría adoptarse para trasplantes a grandes distancias; por ejemplo, trasplantes intercontinentales.
(*) Ver “Reanimación de células cerebrales: Experimentos con cerebros de porcinos muertos”. Newsletter DPT Nro. 39. Julio 2019.
5.- Quinto artículo: Se muestra la viabilidad de la ingeniería cromosómica en mamíferos (5.1.) (5.2) (5.3.)
La ingeniería de cromosomas se ha intentado con éxito en levaduras, pero sigue siendo un desafío en eucariotas superiores, incluidos los mamíferos. En el estudio aquí reseñado, investigadores de la Academia de Ciencias de China (Chinese Academy of Sciences CAS) afirman haber encontrado una técnica novedosa para una fusión programable de cromosomas que produce -en laboratorio- ratones con cambios genéticos “que ocurren en una escala evolutiva de un millón de años”. Esos hallazgos podrían arrojar luz sobre cómo los reordenamientos cromosómicos (que alinean, intercambian o combinan rasgos para producir descendencia) influyen en la evolución.
Usando células madre embrionarias haploides y edición de genes, se fusionaron los dos cromosomas más grandes de ratón (los cromosomas 1 y 2), y dos cromosomas de tamaño mediano (los cromosomas 4 y 5). La conformación de la cromatina y la diferenciación de células madre se vieron mínimamente afectadas. Sin embargo, los cariotipos que portaban los cromosomas 1 y 2 fusionados dieron como resultado una mitosis detenida, poliploidización y letalidad embrionaria, mientras que un cromosoma fusionado más pequeño compuesto por los cromosomas 4 y 5 pudo transmitirse a la descendencia homocigota. Los resultados del estudio sugieren la viabilidad de la ingeniería a nivel de cromosomas en mamíferos.
En el estudio se afirma haber concretado un relevante aporte sobre cómo los reordenamientos cromosómicos pueden afectar la evolución, al mostrar que la ingeniería cromosómica es posible en los mamíferos y al derivar efectivamente un ratón doméstico de laboratorio con un cariotipo novedoso y sostenible. Según Li, estos pequeños cambios pueden tener un gran impacto. Individualmente, las fusiones o translocaciones pueden dar como resultado cromosomas faltantes o adicionales, así como enfermedades como la leucemia infantil. Li cree también que la capacidad de diseñar cambios podría informar la comprensión genética durante milenios, incluida la forma de corregir cromosomas desalineados o malformados.
Los investigadores diseñaron genéticamente una especie de ratón con 19 pares cromosómicos, un par menos que el estándar en esta especie, y parte de estos cambios genéticos pueden transmitirse a la descendencia, afirmó CGTN, un canal de noticias en inglés administrado por el estado chino con sede en Beijing. . Según el South China Morning Post, el ratón, conocido como Xiao Zhu, o “Pequeño Bambú”, fue el primer mamífero del mundo con genes completamente reprogramados.
6.- Sexto artículo: La comparación genómica entre una medusa inmortal y una mortal revela procesos claves del rejuvenecimiento permanente (6.1.) (6.2)
Un equipo de investigadores de la Universidad de Oviedo, dirigido por Carlos López-Otín, logró descifrar el genoma de la “medusa inmortal” -Turritopsis dohrnii- y definir diversas claves genómicas que contribuyen a evitar su muerte. Esta diminuta medusa, de unos pocos milímetros de longitud, tiene la peculiar capacidad de revertir la dirección de su ciclo vital y “rejuvenecer” hacia un estadio anterior asexual llamado pólipol.
La secuenciación del genoma de Turritopsis dohrnii, junto con el de su hermana mortal (Turritopsis rubra), y el uso de herramientas bioinformáticas y de genómica comparativa permitieron a los investigadores identificar genes amplificados o con variantes diferenciales características de la medusa inmortal. Estos genes están asociados con la replicación y la reparación del ADN, el mantenimiento de los telómeros, la renovación de la población de células madre, la comunicación intercelular y la reducción del ambiente celular oxidativo. Todos esos factores afectan a procesos asociados con la longevidad y el envejecimiento saludable. Además, el estudio exhaustivo de los cambios en la expresión génica durante el proceso de rejuvenecimiento en esta medusa inmortal permitió descubrir señales de silenciamiento de genes mediadas por la denominada ruta “Polycomb” y el aumento de la expresión de genes relacionados con la vía de pluripotencia celular. Ambos procesos son necesarios para que células especializadas puedan desdiferenciarse y convertirse en cualquier tipo de célula, formando así el nuevo organismo. Estos resultados sugieren que estas dos rutas bioquímicas son mediadoras fundamentales del rejuvenecimiento cíclico de esta medusa.
Concluye señalando que: (a) más que existir una clave única de rejuvenecimiento e inmortalidad, los diversos mecanismos hallados en el estudio actuarían de forma sinérgica -como un todo- para orquestar el proceso de rejuvenecimiento de la medusa inmortal, (b) el trabajo no persigue la búsqueda de estrategias para lograr una “inmortalidad humana”, sino entender las claves y los límites de la plasticidad celular que permite que algunos organismos sean capaces de revertir su ciclo vital, lo cual permitiría encontrar mejores respuestas frente a diversas enfermedades asociadas al envejecimiento.
Referencias:
(1.1.) Fuente primaria: “Healthy cloned offspring derived from freeze-dried somatic cells” Sayaka Wakayama, Daiyu Ito, Erika Hayashi, Takashi Ishiuchi & Teruhiko Wakayama. Nature Communications. Volume 13, Article number: 3666 (2022). Open Access. Published: 05 July 2022. DOI: /10.1038/s41467-022-31216-4
(1.2.) Fuente secundaria 1: “Investigadores japoneses logran clonar ratones a partir de células liofilizadas” Nippon.com. Ciencia 06/07/2022
(1.3.) Fuente secundaria 2: “Clonan ratones sanos a partir de células liofilizadas” Por Rubén Megía González, Genotipia. Genética Médica News. 8/08/2022.
(1.4.) Fuente complementaria: “Liofilización espermática: un nuevo horizonte en las técnicas de criopreservación” Lydia Gil Huerta. Anales de la Real Academia de Doctores de España. Volumen 5, número 3 – 2020, pp. 495-516
(2.1.) Fuente primaria 1: “Post-Gastrulation Synthetic Embryos Generated Ex Utero from Mouse Naïve ESCs” Shadi Tarazi, Alejandro Aguilera-Castrejon, Carine Joubran, Nadir Ghanem, Shahd Ashouokhi, Francesco Roncato, Emilie Wildschutz, Montaser Haddad, Bernardo Oldak, Elidet Gomez-Cesar, Nir Livnat, Sergey Viukov, Dmitry Lukshtanov, Segev Naveh-Tassa, Max Rose, Suhair Hanna, Calanit Raanan, Ori Brenner, Merav Kedmi, Hadas Keren-Shaul, Tsvee Lapidot, Itay Maza, Noa Novershtern, Jacob H. Hanna, Cell. Open Access. Published: August 01, 2022. DOI:https://doi.org/10.1016/j.cell.2022.07.028
(2.2.) Fuente primaria 2: “Synthetic embryos complete gastrulation to neurulation and organogénesis” Gianluca Amadei, Charlotte E. Handford, Chengxiang Qiu, Joachim De Jonghe, Hannah Greenfeld, Martin Tran, Beth K. Martin, Dong-Yuan Chen, Alejandro Aguilera-Castrejon, Jacob H. Hanna, Michael Elowitz, Florian Hollfelder, Jay Shendure, David M. Glover & Magdalena Zernicka-Goetz. Nature (2022). Published: 25 August 2022. 10.1038/s41586-022-05246-3
(2.3.) Fuente secundaria 1: “With innovative bioreactor as womb, mouse stem cells transform into organ-filled embryos: Research team intends to to try same process with human stem cells” By Mitch Leslie. Science. Vol 377, Issue 6606. 2 Aug 2022 DOI: 10.1126/science.ade2373
(2.4.) Fuente secundaria 2: “Mouse embryo created without egg, sperm or womb: Synthetic mouse embryo models were made solely from stem cells, outside the uterus, at Weizmann Institute of Science” By Abigail Klein Leichman. Israel 21c. August 2, 2022
(2.5.) Fuente secundaria 3: “Mouse embryos grown without eggs or sperm: why and what’s next?: Two research teams grew synthetic embryos using stem cells, long enough to see some organs develop” By Cassandra Willyard. Nature Briefing. News. 25 August 2022. DOI: 10.1038/d41586-022-02334-2
(2.6) Fuente secundaria 4: “New synthetic mouse embryos grown in lab: Study bolsters value of mock embryos for modeling development” By Mitch Leslie. Science. 25 Aug 2022
(3.1.) Fuente primaria: “Exclusive generation of rat spermatozoa in sterile mice utilizing blastocyst complementation with pluripotent stem cells” Joel Zvick, Monika Tarnowska-Sengül, Adhideb Ghosh, Nicola Bundschuh, Pjeter Gjonlleshaj, Laura C. Hinte, Christine L. Trautmann, Falko Noé, Xhem Qabrati, Seraina A. Domenig, Inseon Kim, Thomas Hennek, Ferdinand von Meyenn, Ori Bar-Nur. Stem Cell Reports. Open Access. Published: August 04, 2022. DOI: 10.1016/j.stemcr.2022.07.005
(3.2.) Fuente secundaria: “Científicos suizos consiguen que ratones estériles produzcan esperma de rata” Por Iole Ferrara Romeo. Boletín SINC. 5/8/2022
(4.1.) Fuente secundaria: “Scientists brought a dead pig’s cells and organs back to life: and yours could be next: Your organs could live longer than you. By Rupendra Brahambhatt. Science. Interesting Engineering. Aug 3, 2022.
(4.2.) Fuente complementaria: Broad Institute
(4.3.) “Scientists revived some organs in dead pigs: What are the implications?” By Katharine Lang on— Fact checked by Hannah Flynn. Medical News Today. August 10, 20222
(5.1.) Fuente primaria: “A sustainable mouse karyotype created by programmed chromosome fusión” Li-Bin Wang, I-Kun Li, Le-Yun Wang, Kai Xu, Xtian-Tian Ji, Huan Maosi-Nan, Matao Liucheng-Fang Tu[…]Wei Li. Science. Vol 377, Issue 6609. pp. 967-975. 25 Aug 2022. DOI: 10.1126/science.abm1964. DOI: https://www.science.org/doi/10.1126/science.abm1964
(5.2.) Fuente secundaria 1: “Researchers engineer first sustainable chromosome changes in mice” by Chinese Academy of Sciences. Phys.org. August 25, 2022
(5.3.) Fuente secundaria 2: “Chinese scientists claim to have engineered the world’s first mouse with fully reprogrammed genes: This finding “proved” the significance of chromosomal rearrangement, a crucial evolutionary indicator of the emergence of a new species” By Baba Tamim. Interesting Enginmeering. Science. Aug 27, 2022
(6.1.) Fuente primaria: “Comparative genomics of mortal and immortal cnidarians unveils novel keys behind rejuvenation” Maria Pascual-Torner, Dido Carrero, José G. Pérez-Silva, Diana Álvarez-Puente, David Roiz-Valle, Gabriel Bretones, David Rodríguez, Daniel Maeso, Elena Mateo-González, Yaiza Español, Guillermo Mariño, José Luis Acuña, Víctor Quesada and Carlos López-Otíns. Edited by Vera Gorbunova, University of Rochester. Proceedings of the National Academy of Sciences (PNAS) 119 (36) e2118763119. Research Article. Developmental Biology. August 29, 2022. DOI: 10.1073/pnas.2118763119
(6.2.) Fuente secundaria: “Descifran el genoma de la medusa inmortal” Boletín SINC. Ciencias de la Vida. 29/8/2022


