Newsletter DPT Nro. 87
ISSN 2618-236X
Agosto / 2023
NOTICIAS CIENTIFICAS
NOTICIAS CIENTIFICAS INTERNACIONALES
Criopreservación de tejidos y órganos
Nuevos aprendizajes con notables perspectivas
En un día cualquiera, más de 100 000 personas (sólo en EE.UU.) esperan trasplantes de órganos para salvar sus vidas. La Organización Mundial de la Salud estima que realmente obtienen trasplante de órganos menos del 10% de las personas que lo necesitan. Además de no disponerse de suficientes órganos para cubrir la creciente demanda, el sistema no aprovecha satisfactoriamente las posibles donaciones y muchos órganos donados se deterioran antes de llegar a un destinatario. Más del 60% de los corazones y pulmones donados deben descartarse por no haber llegado a tiempo a un receptor.
Preservados en hielo, el actual estándar en medicina de trasplantes, los corazones y pulmones pueden durar entre 6 y 8 horas. Ese período de tiempo aumenta a 12 horas para hígado, 18 horas para páncreas y 36 horas para riñones. Debido a la premura, cada trasplante es tratado como una “crisis” y el actual sistema reúne diversos factores de inequidad en la probabilidad de recibir un trasplante.
El referido escenario podría cambiar sustancialmente con ٳos avances previsibles en criopreservación de tejidos y órganos. Al respecto, la presente reseña comprende dos artículos. El primero (1) se refiere al potencial y la complejidad de la criopreservación de órganos. El segundo (2) trata sobre una relevante experiencia de criopreservación, reanimación e implante de un riñón de rata.
1.- Primer artículo: El potencial y la complejidad de la criopreservación de órganos (1.1.) (1.2.)
La criopreservación es hoy un proceso imprescindible en la investigación biomédica, así como en diversas aplicaciones médicas, desde la reproducción asistida y los trasplantes hasta las terapias celulares y la identificación de biomarcadores (*).
Los recientes avances en criopreservación llegan en un momento en que el sistema estadounidense de trasplante de órganos transita un intenso escrutinio. En agosto pasado, una investigación del Senado de EE.UU. reveló problemas de coordinación, supervisión y transporte, así como numerosos errores que resultaron en la muerte o daños de los receptores de trasplantes.
La crioconservación ofrece la posibilidad de almacenar los órganos durante días, meses o incluso años antes de implantarlos. Ello permitiría a los médicos encontrar y seleccionar órganos con mayor compatibilidad inmunológica con los receptores; una mayor equidad en el acceso; una mejor preparación de los receptores para mejorar la aceptación y reducir el riesgo de rechazo; mejores protocolos de tolerancia al trasplante; mayor tiempo para reservar quirófanos, reunir al personal pertinente y asegurarse los insumos necesarios. Por otra parte, se reduciría sustancialmente el desecho de órganos donados no utilizados, ya habría bancos de tejidos, órganos e incluso extremidades criopreservados. Pero los potenciales beneficios de los avances en crioconservación se extienden también a muchos otros usos, tales como tejidos para evaluar productos farmacéuticos, especies en riesgo de extinción y embriones de peces para acuicultura, entre muchas otras posibilidades.
Las complejidades de la criopreservacion
La criopreservacion se basa en complejos procesos y reacciones fisicoquímicas que tienen efectos negativos en las células. Las membranas lipídicas pueden ser destruidas por los cristales de hielo o por la caída de temperatura, la deshidratación causa deformación estructural de la célula y los crioprotectores tienen efectos citotóxicos. Estos factores disminuyen la posterior viabilidad y proliferación, pero también pueden provocar perturbaciones más profundas y complejas en la identidad y funcionalidad de las células.
Nuevos aprendizajes con relevante potencial
Durante los últimos años, tras décadas de progreso vacilante, se lograron notables avances en la utilización del frío extremo para retrasar o detener la descomposición de órganos vivos. Se desarrollaron nuevas formas de reducir la toxicidad de los tratamientos químicos anticongelantes, minimizar la formación de hielo destructivo y descongelar tejidos y órganos de manera rápida y uniforme.
El trabajo con embriones de ratón allanó el camino para almacenar embriones humanos, transformando el tratamiento de fertilidad. Pero lo que funciona para un diminuto embrión de unas 100 células no es fácilmente aplicable en órganos enteros. Es difícil lograr que el crioprotector penetre uniformemente en una pieza de tejido más grande.
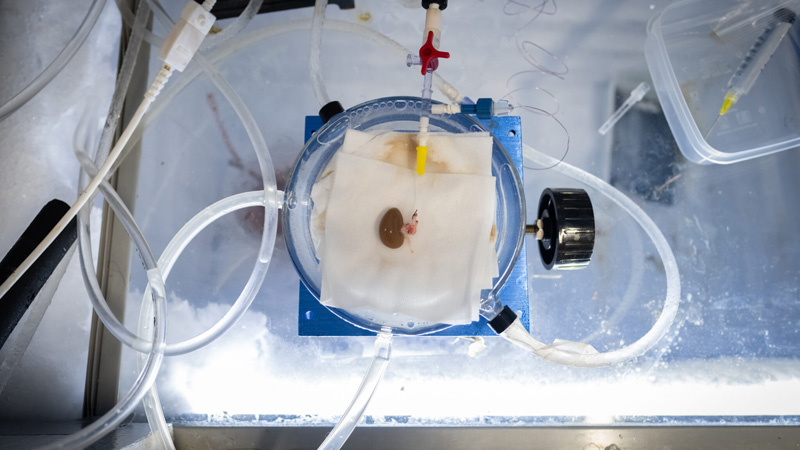
Un equipo de la Universidad de Minnesota desarrolló un enfoque, denominado “nanocalentamiento”, que descongela al órgano de manera uniforme para evitar daños por hielo. Adoptando como ejemplo un riñón de rata, los pasos son los siguientes: (a) Crioprotector: Se infunde en el riñón un agente crioprotector (líquido descongelante); el cual también contiene nanopartículas magnéticas de óxido de hierro que se esparcen por el órgano; (b) Gran enfriamiento: El riñón tratado se enfría a –150°C, con lo que el líquido del riñón se vitrifica (adquiere un estado similar al vidrio), resultando menos dañino, para las células vivas, que el hielo cristalino; (c) Recalentamiento magnético: Una corriente que fluye a través de una bobina crea un campo magnético que invierte los polos positivo y negativo 360 000 veces por segundo, calentando las partículas de óxido de hierro y descongelando al órgano de manera uniforme; (d) Lavado: Se eliminan del riñón las partículas de hierro y los crioprotectores tóxicos, y (e) Trasplante: el riñón es trasplantarlo a una rata, donde reanuda su funcionamiento.
Antes de que cualquier tecnología de criopreservación de órganos llegue a los quirófanos, no solo deberá escalar hasta el tamaño humano, sino que también deberá superar el examen de los entes reguladores de seguridad, como la Administración de Alimentos y Medicamentos (FDA) de EE. UU..
(*) Ver noticia “Criopreservación: vida congelada: Actuales tendencias y una guía operativa” Newsletter DPT Nº 52, Septiembre 2020.
2.- Segundo artículo: Una experiencia exitosa de criopreservación, revitalización e implante de riñón animal (2.1.) (2.2.)
El riñón de rata era peculiarmente llamativo: una víscera del tamaño de una moneda mediana, como una piedra preciosa y reluciente. Dicha apariencia se debía a un proceso de vitrificación, con un descenso de temperatura (en vapor de nitrógeno líquido) a –150°C, que condujo al riñón a un estado de animación suspendida. Luego, los investigadores de la Universidad de Minnesota reiniciaron el reloj biológico del riñón, calentándolo antes de volver a trasplantarlo en una rata viva, que sobrevivió a la dura experiencia.
en un estudio cuyos resultados se publicaron en Nature Communications. Un total de 5 ratas recibieron riñones recalentados (tras haber sido vitrificados). Por primera vez se demostró que es posible trasplantar con éxito un órgano de mamífero que mantenga la vida después de haber sido recalentado tras el paro metabólico con vitrificación. Expertos externos calificaron los resultados como un hito fundamental en materia de preservación de órganos. Si esos resultados pudieran trasladarse exitosamente a humanos, la criopreservación y el recalentamiento de órganos podrían revolucionar la medicina de trasplante.
Aunque los riñones de rata sufrieron algunos daños durante los procesos de vitrificación y recalentamiento, el equipo de la Universidad de Minnesota expresó que podría comenzar a refinar y probar la técnica en órganos humanos dentro de 1 o 2 años. Los ensayos clínicos, dijeron, podrían llevar otros 5 o más años. Se sabe que los ensayos clínicos de trasplantes son excepcionalmente desafiantes. Incluso si todo ello resultara favorable, el despliegue generalizado de una red nacional de bancos de órganos criopreservados llevará tiempo y planteará cuestiones éticas sobre quién recibe qué tipo de trasplante y en qué medida penetra el comercio en el sistema de trasplante de órganos.
Aun cuando ciertas criaturas pueden sobrevivir a temperaturas bajo cero, la “animación suspendida” fue, hasta ahora, una fantasía. Durante décadas resultó frustrante la pretensión de recuperar órganos criopreservados sin lesiones y con plena funcionalidad. Pero el equipo de la Universidad de Minnesota parece haber comenzado a tener éxito con la vitrificación y reanimación de células humanas, de ratón y de cerdo, así como de corazones e hígados de rata.
Bischof y sus colegas pasaron años desarrollando tecnología para recalentar materiales vitrificados con suficiente rapidez como para evitar la formación de cristales de hielo en la transición física desde el vidrio. Su técnica, llamada nanocalentamiento, utiliza una bobina de cobre de radiofrecuencia para crear un campo magnético que excita nanopartículas de hierro en todo el órgano al mismo tiempo. Los riñones experimentales nanocalentados no funcionaron a la perfección. Durante las fases iniciales; sus funciones parecieron reducirse aproximadamente en un 50%. Pero a las 3 semanas, funcionaban como riñones normales. Cabe señalar que las ratas donantes y receptoras eran relativamente jóvenes (entre 4 y 8 meses de edad), lo que podría no ser representativo de la salud de los donantes de riñón humanos reales (que a menudo han fallecido recientemente) o de los receptores (que suelen tener enfermedades crónicas e irreversibles).
Los investigadores de la Universidad de Minnesota dijeron que planean pasar los próximos 6 meses intentando escalar su método de crioconservación hasta los órganos de cerdos: un cambio de tamaño que, en términos de riñones, equivale a pasar de una uva grande a una pera. A medida que avancen, continuarán estudiando si los órganos animales recalentados recuperan sus propiedades fisiológicas, químicas y eléctricas originales.
Más adelante, si todo va bien, podría crearse bancos vivientes donde los órganos, la piel, los nervios, los vasos sanguíneos, los cartílagos y las células madre se conserven en nitrógeno líquido durante años hasta que coincidan con los pacientes adecuados. Pero esa visión todavía está a varios años de distancia. Es muy difícil realizar ensayos clínicos en trasplantes. A medida que se desarrolle la infraestructura de los bancos de órganos, los posibles receptores enfrentarán nuevas desigualdades: si los bancos de órganos se convierten en una industria comercial con fines de lucro, será probable que los pacientes más ricos y mejor asegurados sean los primeros en beneficiarse.
Referencias:
(1.1) “Scientists are learning how to cryopreserve living tissues, organs, and even whole organisms, then bring them back to life” By Wwarren Cornwall. Science. 21 Jun 2023. American Association for the Advancement of Science. DOI: 10.1126/science.adj3555
(1.2.) “Vitrification and nanowarming enable long-term organ cryopreservation and life-sustaining kidney transplantation in a rat model” Zonghu Han, Joseph Sushil Rao, Lakshya Gangwar, Bat-Erdene Namsrai, Jacqueline L. Pasek-Allen, Michael L. Etheridge, Susan M. Wolf, Timothy L. Pruett, John C. Bischof & Erik B. Finger. Nature.Nature Communications. Volume 14, Article number: 3407 (2023). Article. Open Access. 09 June 2023. DOI: 10.1038/s41467-023-38824-8
(2.1.) “Scientists successfully unfroze rat organs and transplanted them — a ‘historic’ step that could someday transform transplant medicine” By Marion Renault. STAT In The Lab. June 21, 2023
(2.2.) “Bringing frozen organs back to life: A cryopreserved rat kidney” News From Science.Health,


